技術レポートシリーズNo.001-0
Technical Report

技術レポートシリーズ No. 001-0
2021/12/27 初版
自動細胞培養装置導入について
CellQualia -Intelligent Cell Processing System- 導入のメリット
Contents
1. はじめに
2. 細胞培養装置には3種類ある
3. ロボットと装置の違い
4. スケールアップとスケールアウト
5. CellQualia Intelligent Cell Processing Systemのメリット
要旨:細胞医薬品の開発と工業的生産の効率化や加速化のためには装置化が重要で、手生産における量的・時間的な制約を大幅に緩和することができ、人手の関与が減るため、作業ミスも大幅に減らすことができる。自動細胞培養装置にはロボットタイプと装置タイプがあり、前者は手作業を完全に模倣できるが、設定の難しさや開放系作業による微生物汚染への対処などの課題がある。一方、CellQualia Intelligent Cell Processing Systemは閉鎖流路系を採用した培養装置で、プロセスモニタリングや継代の機能があり、動作の単純化により設定も容易である。また、培養には単一の容器を使用するので、複数の容器を使用する方法よりは生産スケールは小さいが、ロットの品質管理は容易である。プロセスモニタリングによる製造の安定化やQbDによる品質保証を図れば、同装置の複数台での運用によって製造の質を変えずに容易にスケールアップやスケールアウトも可能となり、治験薬の製造や自家細胞の製造と、工業スケールの製造が1種類の装置だけでできるという画期的な製造プラットフォームになり得る。
はじめに
医薬品の開発の目的は、『有効な治療法がない』あるいは『治療法があっても十分ではない』疾患の患者さんに対し、『有効』で『安全』な医薬品を『早く』、『多くの患者さんに』、『安く』届けることにある。基礎研究での試行錯誤の結果として医薬品候補物質が見つかり、非臨床研究で有効性や安全性を示唆するデータが得られると、臨床試験での確認の準備が始まるが、医薬品メーカーではこの段階でCMC(Chemistry, Manufacturing and Control)部門が重要な役割を担う。CMC部門のミッションには大きく分けて2つあり、1つは『新規医薬品の開発に必要な量の治験薬をタイムリーに供給すること』で、もう1つは『商業スケールでの製造法の確立や、製造販売承認後に製法や製造場所の変更の必要が生じた場合に対応する』である。
細胞医薬品についても同じ事が当てはまり、Chemistry(化学)をCell(細胞)に置き換えて考えればよい。ただ、低分子化合物やバイオロジクスと細胞で異なる点があるとすれば、治験用の製造と商用の製造に相違が生じた場合、細胞は化学的分析だけでは同等性を証明することが非常に困難で、また、製造プロセスの変更が、製品である細胞の品質に大きく影響する可能性が高いことが挙げられる。ここで敢えて『製品である細胞』という表現を使った理由は、『原料である細胞』も存在するからである。また、細胞医薬品は低分子化合物やバイオロジクスに比べると大量製造の方法は開発途上で、現実的には治験用製造に開発した技術から収量を大きく増やすには、技術開発に相応の時間と費用を費やすことになり、それだけ医療としての提供が遅れることになる。一方、自家細胞の場合は工業的スケールの生産などは必要なく、原料ですらロットごとに異なるので、生体から取り出した細胞は加工を必要最小限にとどめ、それで品質を担保することになる。
さて、細胞医薬品に限らず大量製造の場合、同一ロット内は同一品質とみなし、出荷前の検査によって全量の品質を保証する。このやり方をQuality by Testing(QbT)と呼ぶ。一度に大量に作れば単位量あたりのコストは下がる一方で、不具合が見つかれば全量アウトとなり、特に細胞医薬品のようは製造コストが高い製品の場合、重大な損失を被る。そのため、細胞医薬品の製造にはスケールアップに特有の技術とノウハウが必要で、熟練スタッフが製造にあたる。しかし、手生産には量的にも稼働時間的にも限界があり、作業ミスを完全に防いだり把握したりすることは難しい。
図1 作業ミスを完全に防ぐのは難しい
細胞培養装置には3種類ある
手生産の課題を解決するため、これまでも様々なタイプの細胞培養装置が開発されてきた。一つ目は、人手での作業の一部を補助したりスケールアップしたりするもので、製造プロセスが原理的に大きく異なることはない。但し、スケールを大きくすれば作業時間も長くなり、その場合は作業の質に差が生じることになる。2つ目は、人手での作業をロボットや装置で完全に代替するもので、いわゆる自動細胞培養装置が該当する。これも製造プロセスが原理的に大きく異なることはない。3つ目は、バイオリアクターによる浮遊培養装置や、ホローファイバーによる還流培養装置のように、製造プロセスを原理的に大幅に変え、スケールアップや省力化を図るタイプのものである。浮遊系の細胞の場合には非常に有効な方法であるが、接着性の細胞に適用する場合には注意が必要である。2つ目と3つ目のタイプの装置は、自動化や連続培養によって手生産における量的・時間的な制約を大幅に緩和することができ、人手の関与が減るため、作業ミスも大幅に減らすことができる。
MSCやiPS細胞の場合、マイクロキャリアの利用やスフェア形成による浮遊培養の適用も報告されているが、本来は接着培養で樹立され維持されている細胞であり、原理的に異なる培養法の適用による質的変化への影響(MSCの場合は有効性、iPS細胞の場合は多分化能)については慎重に検討する必要があると考える。
ロボットと装置の違い
自動細胞培養装置にはロボットタイプと装置タイプがあると先に述べたが、その違いを以下のようなものである。
まず、ロボットは従来の人手での作業をほぼ忠実に模倣して細胞や原材料のハンドリングを行なう。作業の工程はヒトと同じようにステップ・バイ・ステップで、フレキシビリティが高く、特に培養フラスコや試薬ビンの蓋の開閉といった難易度の高い作業もこなすことができる。一方で、そのような繊細な作業を行わせるための動作の設定は難しく、調整が不十分だと思わぬ場所にピペットが引っかかって停止したり、ハンドリングの途中で容器を取り落としたりする恐れがある。また、培養操作は手作業と同様に開放系なので、微生物汚染対策のための作業エリアの定期的な滅菌が必要となる。作業工程における細胞のモニタリングは、顕微鏡撮像であれば可能であるが、培地成分のモニタリングなどを組み込むのは新たな装置や工程を組み込むことになり、スペースや設定の面でのハードルが高い。
一方、装置は細胞や原材料のハンドリングを単純化した動作に置き換えるので、フレキシビリティが低い(決まった動作しかできない)。しかし、ロボットアームに比べてモーションの範囲が狭い(構造がコンパクト)ため、いくつものユニットを並置して動作させたり、動作が早いので同じ作業を繰り返し行わせたりできる。また、動作が単純であるという事は、あらかじめ動作メニューを用意することができ、設定はそこから選ぶだけなので非常に簡単である。培養操作自体は開放系のシステムか閉鎖系のシステムのいずれかの装置を選ぶことになるが、開放系の場合はロボットと同様に微生物汚染対策のための作業エリアの定期的な滅菌が必要となる。一方、閉鎖系システムの場合は、送液チューブを含むすべてのパーツをディスポにすることで、無菌性の管理が容易に行える。さらに、培養中の細胞の撮像に加えて送液系の途中にインラインセンサーを組み込むことができ、作業プロセスのより詳細なモニタリングが可能になる。
当社のCellQualia Intelligent Cell Processing (ICP) Systemは、閉鎖系流路を採用した全自動培養装置で、細胞の撮像とインラインセンサーに加え、オフライン解析用のサンプリング機能も有することを特徴とする。また、自動化の範囲には細胞の継代も含まれる。

スケールアップとスケールアウト
先に述べたように、細胞医薬品を安く提供しようとすれば、培養のコストを下げるための培養のスケールアップが重要となる。数十枚のシャーレや数十本のフラスコを人手で取り扱うのには労力的に限界があり、作業の均一性の確保やミスの排除のためには自動細胞培養装置の導入が有効である。
一方、自家細胞製品やiPS細胞バンクなどの場合は、各患者/ドナーの細胞ごとに少量製造すること(スケールアウト)になり、同じく作業の均一性の確保やミスの排除のためには自動細胞培養装置の導入が有効である。
いずれの場合も、いつから自動培養装置に切り替えるか?が思案のしどころになる。先に述べたように、細胞は化学的分析だけでは同等性を証明することが非常に困難で、また、製造プロセスの変更が、製品である細胞の品質に大きく影響する可能性が高い。
CellQualia Intelligent Cell Processing Systemのメリット
CellQualia ICP Systemの詳しい説明は製品カタログや当社HP (https://www.sinfo-t.jp/biomedical/icp-system.html)などを参照して頂くとして、他の装置と比較した場合の当社装置のメリットを以下に紹介する。但し、バイオリアクターによる浮遊培養装置や、ホローファイバーによる還流培養装置のように、製造プロセスを原理的に大幅に変えるものは、ここでは対象外とする。
当社装置の最終の培養スケールはCorning®のHYPERStack®を用いた場合は36層で18,000 cm2となり、表面積で計算すると100 mm シャーレであれば990枚、T150フラスコであれば120本に相当し、MSCであれば500,000,000個程度の細胞が一度の培養で得られる(つまり1ロット)。ロボットの場合、培養容器としてシャーレを使用するものを多く見かけるが、仮にT150フラスコが使用できるものであっても、この数の容器ではハンドリングに相当な時間を要す。例えば、培養が完了して細胞を回収する場合、最初に剥離・回収して保存しておいた細胞と、最後に剥離・回収した細胞の質的な差が気になるところではあるが、現実的には全ての容器から剥離・回収した細胞を纏めて一つのロットとするであろう。人手や補助装置を使って複数の多層容器で培養した場合は、本数を多くすれば得られる細胞も増えるが、ロボットの場合と同様に作業の時間差の影響が懸念される。
さらに、容器が1つであることのメリットは、ロットごとの製造工程の変動をPAT(Process Analytical Technology)でモニタ出来る点である。複数の容器の場合、個々の容器の細胞の撮像は可能であるが、培地分析を適用するのは不可能に近い。また、複数容器の場合は播き込みにも時間差が生じてしまい、そうなると原料である細胞に質的な差が生じる可能性があるが、容器が1つであれば播き込みは1回の操作で完了する。
さて、細胞製造のように不均質な原材料の品質や変動のある製品の製造に対しては、『品質は最終段階でテストするだけでなくプロセスの段階ごとに確立する必要があり、これにより最終製品の一貫した品質を得ることができる』というQbD(Quality by Design)の考え方を採用するのが有効である。細胞のCQA(Critical Quality Attribute、品質規格値)やリスク評価に基づくDS (Design Space、規格許容幅)の設定や製造工程のPW(Process Window、工程幅) の設定を行い、製造プロセスのデータで品質を担保する。本装置ではPATによってリアルタイムで細胞の培養状態を観察・測定できるので、 DS や PWの範囲中にあると観察・測定されれば、ロットごとの最終品質確認、すなわちQbT(Quality by Testing)を行なわずとも製品を出荷することが出来るようになる。
また、QbDに基づいた製造が可能な装置であるという事は、CellQualia ICP Systemを複数台使用して並列して生産した製品は、先に述べたDSやPWの範囲にある限り、同品質であるという事ができる。これは製造の質を変えずに容易にスケールアップやスケールアウトが可能ということで、治験薬の製造や自家細胞の製造と、工業スケールの製造が1種類の装置だけでできるという画期的な製造プラットフォームになり得る。
一方、CellQualia ICP Systemは単なる製造装置としての使い方だけでなく、細胞製品のCQAやプロセスのDS、PWを設定したり、品質マネジメントプラットフォームを構築したりするための基盤とすることも可能になる。例えば、年齢や健康状態といったドナーの情報や、採取から初代培養化、凍結までの手順と継代数、QC(quality control、品質管理)データなどは採取・分与機関から入手する。培地や継代試薬、培養容器などは、製品のロット番号とQA(quality assurance、品質保証)シートがベンダーから提供される。原材料の受け入れ時は各製造施設でのQCが行われ、製造プロセスデータは先述のように本装置で記録することができる。また、オフライン解析データや最終製品のQCデータや非臨床試験のデータなども製造プロセスと紐づけることができ、包装までの後工程や、保存、配送といったデータも収集して、MES(Manufacturing Execution System、製造実行システム)やLIMS(Laboratory Information Management System、ラボラトリー情報管理システム)といった上位の生産管理システムで統合する。さらに、臨床での投与量や有効性、副作用、新たな適用を目指した治験などのデータも加えることで、細胞医薬品を用いた医療をひとつのシステムとして統合することが可能になり、信頼性の高い医療として患者に提供することができる。当社ではFBRIの川真田先生と共同で、そのようなシステムの構築の検討も開始した。本装置の普及によって細胞医薬品製造の産業化が加速することを願っている。
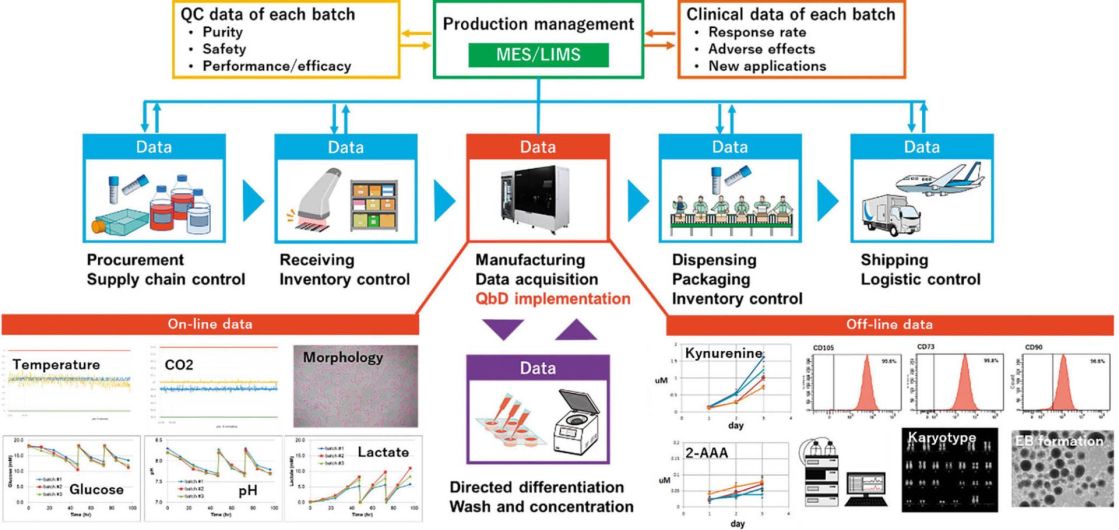
図2 CellQualia Intelligent Cell Processing Systemを中心とした細胞生産システムのイメージ
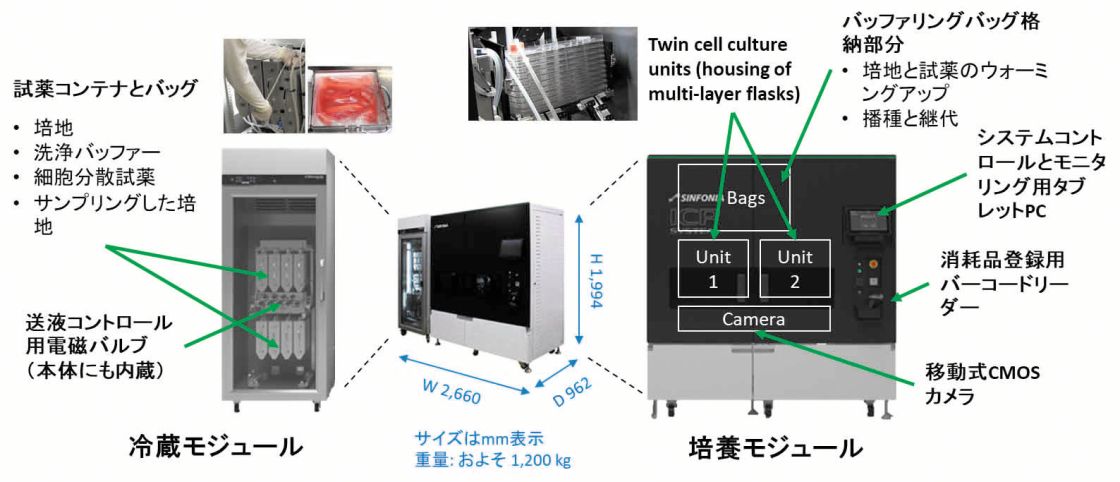
図3 CellQualia Intelligent Cell Processing Systemの概要
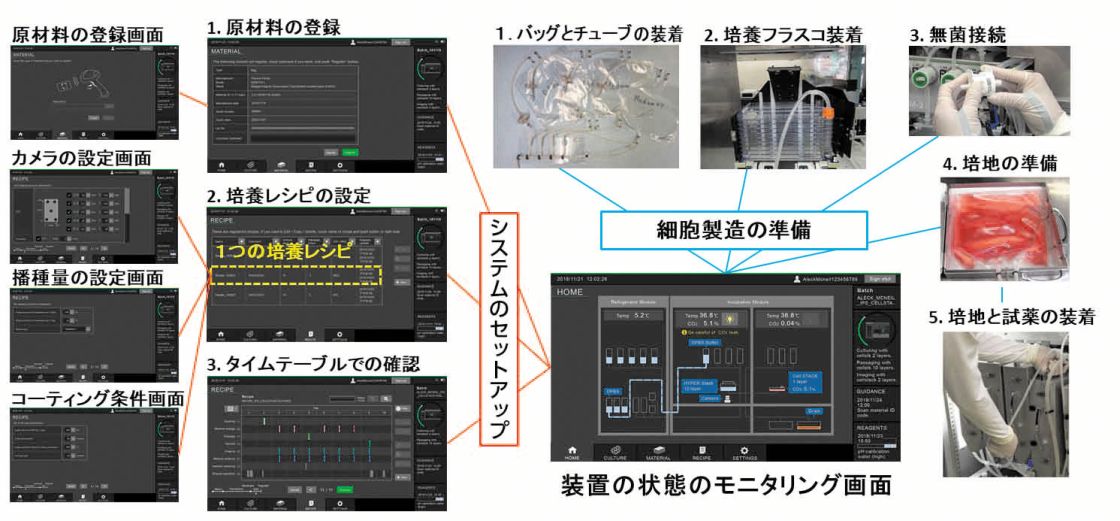
図4 CellQualia Intelligent Cell Processing Systemのセッティング