技術レポートシリーズNo.002-0
Technical Report

技術レポートシリーズ No.002-0
2021/12/27 初版
① MSC 編
Contents
1. はじめに
2. MSC製品製造における課題
3. 自動細胞培養装置の必要性
4. 当社装置の特徴
5. CellQualia Intelligent Cell Processing System の導入で何が変わるか?
6. 参考文献
要旨:MSCには炎症や免疫を抑制する効果などがあり、国内ではGVHDや脊髄損傷を適用とした製品が上市され、様々な疾患治療への応用研究も行われている。一方、MSCの有効性や安全性と直接関係する品質指標は依然として不明であり、細胞の老化に伴う形態変化や増殖速度の変化などがサロゲート指標となっている。現在、人手による製造ばらつきの排除や、省力化、スケールアップなどのための各種培養装置やロボットが開発され、販売されているが、装置であればプロセスの質を測定・評価する手段を組み込むことができる。そこで当社は、プロセス解析技術を搭載し、臨床で必要な量の細胞の製造を、播種から収穫まで閉鎖系かつ全自動で製造できる装置としてCellQualia Intelligent Cell Processing Systemを新たに開発した。本装置を用いれば、バッチごとのプロセスデータの取得・蓄積・解析が可能になり、それらをもとにした品質管理が行える。さらに、上位の生産・物流・販売管理システムと連携させることで、原料から臨床まで一貫した品質マネジメントが実現でき、最終製品の有効性や安全性と関連する重要品質属性の解明へと繋がる。最終的には、本装置を中心とした品質マネジメントプラットフォームを普及させ、広く活用することで、従来はメタ解析に頼っていた臨床試験や治験間の比較が容易になり、MSCの適用拡大と産業化が加速することを期待する。
はじめに
MSC(mesenchymal stem cell:間葉系幹細胞)は、インビトロでは繊維芽細胞様の形態を呈する細胞で(図1)、骨、軟骨、脂肪などの中胚葉性組織への分化や、免疫制御などの能力を有することから、細胞医薬品あるいはその原材料として利用あるいは検討が行われている。例えば日本では既にGVHD(graft-versus-host disease、移植片対宿主病)や脊髄損傷に伴う神経症候・機能障害を適用とした製品が承認されており、その他の疾患治療への応用についても臨床研究や治験が数多く進められている。その一方で、MSCは不均一な細胞集団であり、その性質は由来組織、ドナー、培養条件、継代数などで変動すると言われ、それらに起因する品質上の課題が指摘されている。
MSCの定義としては、ISCT(International Society for Cellular Therapy、国際細胞療法学会)が『プラスチック容器への接着性』、『特異的な表面抗原セットの発現・非発現』、『多分化能』の3点を提唱1)しているが、臨床における有効性や安全性を担保するというよりは、MSCの治療応用を目指した数多くの研究に対し、結果を比較可能なものとするためにMSCであることの基準を提供するといった性格のものである。
今後さらに多くの患者さんにMSCを医薬品として提供するためには、安定で効率的な生産技術の確立はもちろんのこと、医薬品として安全性や有効性を正当に評価し、担保するための品質の理解・管理の方法の確立が非常に重要なポイントとなる。低分子医薬品の場合は、治験薬や製品の品質は薬物量、不純物(添加物を含む)量、分解物量などの化学的規格と、剤型、保存条件などの物理的規格で規定できる。一方、細胞医薬品は原材料も製品も生きている細胞であり、そのために様々な要因によって品質が変動する可能性をはらんでいる。また、細胞の品質指標と評価方法は多様である一方で、それらと臨床における安全性や有効性との関連性についての知見は充分とは言えない。
現時点では治験や臨床研究ごとに用いられるMSCの不均一性を排除する事は不可能に近いため、用量設定2)や有効性評価2,3)に関してはメタ解析が行われたりしているが、その結果はあくまでも推定に過ぎず、有効性や安全性が厳密に担保された医療として患者に提供するためには、統一した規格に基づく検証と製品の提供が必要ではないかと考える。
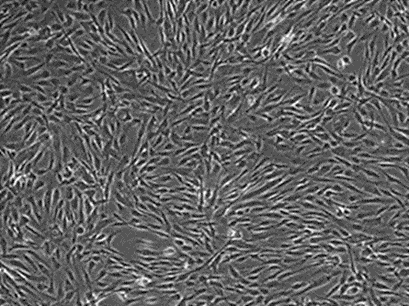
図1 ヒトMSC(位相差像)
MSC製品製造における課題
MSCは幹細胞の一種ではあるが、ES細胞のように自己複製能を維持するためのシグナル系を活性化させながら培養するわけではないので、継代に伴って変性したり老化したりする懸念がある4)。実際、継代を重ねると増殖速度が低下し、やがて停止する。また、繊維芽細胞様の形態をした集団の中に扁平状の細胞が出現し、その割合は継代に伴って増加してゆく。さらに、MSCの老化はドナーの加齢とも関連し5)、若年者ドナーから採取した細胞を、過剰に継代数を増やすことなく製造するのが最善とされているが、継代数の方がより影響が大きいとの報告もある6)。
また、MSCに期待されている薬効メカニズムとして、様々な増殖因子やサイトカインの産生と免疫調節作用、疾患部位への遊走・集積、血管新生作用などがあるが、原料から製品に至るプロセスのどの要因が臨床におけるどの薬効に影響を与え、そのためには何を制御して製造すべきという情報は、臨床データとセットにしないと得られない7)。少なくとも現時点では、薬効と関連付けられたMSCの品質指標は知られていない。
仮に継代数の問題を除けば、細胞をベースとする治験薬あるいは製品の質を一定にする最も単純な方法は、製造のバッチサイズを極力大きくし、その一部を用いてそのバッチの有効性と安全性を確認することである。ただ、この方式は、かなり大きなスケールで製造しない限り経済的に見合わないと思われ、バッチが変わった際に全く同じ品質の細胞が得られるという保証はない。
自動培養装置の必要性
MSCに限らず、細胞を培養している間は位相差顕微鏡で定期的に細胞の様子を観察したり、継代では剥離した細胞を計数して再播種したりするので、熟練者は形態や増殖速度の変化をもとに播種密度や継代数、培地交換タイミングを調整したり、場合によっては培養中止の判断を下したりしている。しかし、それらの情報は局面ごとの結果であり、異常か否かの判断は下せても、それに繋がる兆候がいつから、何をきっかけに起きたかという事を知るには不十分である。また、人手では操作の質やタイミングなどの画一化や誤操作排除が難しく、原料から製品に至る培養手順を事細かに記録して後から確認するのは非常に困難なので、自動培養装置が必要となってくる。
既に、人手による製造ばらつきの排除や、省力化、スケールアップなどのための各種培養装置やロボットが開発・市販されている。ロボットはフレキシビリティが高く、熟練者の作業をほぼ完全に模倣できる点が良く、装置はフレキシビリティには乏しいが各動作は単純化され、同じ動作を並行で行ったり異なる動作を組み合わせたりできる。
先にも述べたように、細胞医薬品は原材料も製品も生きている細胞であり、そのために様々な要因によって品質が変動する可能性をはらんでいる。自動培養装置の場合には、プロセスの解析・記録機能を装備することができる。培養中の細胞の画像や装置内の環境情報を取得して記録する装置は多いが、細胞の状態をさらに詳細にモニタするためには、細胞の代謝物解析なども行わなければならない。装置であれば、インライン分析用のセンサーや、オフライン分析用のサンプリング機能を容易に組み込むことができる。そこで当社では、再生医療の産業化における品質管理の問題に取り組んでおられる公益財団法人神戸医療産業都市推進機構(FBRI)の川真田伸先生との協業により、PAT(Process Analytical Technology、プロセス解析技術)を搭載したCellQualia Intelligent Cell Processing Systemを開発した。

図2 CellQualia Intelligent Cell Processing Systemの外観
本体は、冷蔵ユニット(左側)とインキュベーターユニット(右側)から構成される。
当社装置の特徴
図2に装置の外観を示す。冷蔵ユニットでは、バックに詰めた培地や試薬、培養中に採取した培地サンプルや収穫した細胞などをカセットに収納して冷蔵保存する。インキュベーターユニットは多層フラスコを設置する培養ユニットを2つ内蔵し、培地交換だけでなく、ユニット間の継代も自動で行うことができる。各バッグとフラスコは図3で示すように流路(チューブ)で繋がれ、完全な閉鎖系を形成する。多層フラスコは市販のものに対応し、最大で36層のものが装着できる。
チューブ類とバッグはテンプレートと呼ぶ支持板に固定した形式で提供し、装着エラーを減らすように工夫している。また、テンプレートはディスポーザブルとすることで細胞のクロスコンタミネーションが防止され、無菌接続端子の採用によって微生物汚染が防止される。
人手での培養の場合、定点観測的に同じ場所の細胞を観察することは難しいが、当社の装置では培養中に容器の下部にCMOSカメラが設置され、あらかじめ設定した場所(最大5か所)を定期的に撮影するだけでなく、図3で示すようなモニタ画面上から操作してカメラを別の場所に移動させ、他の部位の細胞の状態を任意のタイミングで確認することもできる。また、装置の付属ソフトウエアでコロニーの端部を認識し、それをもとに細胞の専有面積を算出することで、いわゆるconfluencyを数値化することもできる。
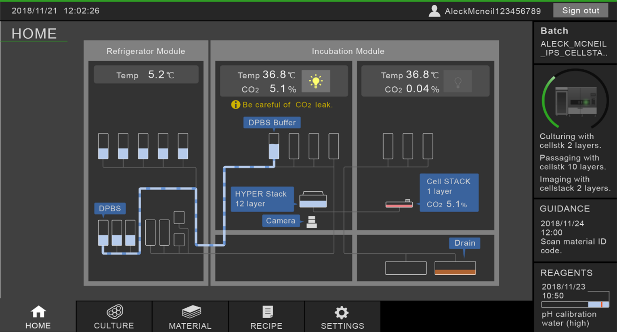
図3 培養プロセスのモニタ画面
流路系の構成と各バッグの液量、送液の状態、培養環境温度やCO₂濃度、カメラの位置などが表示される。
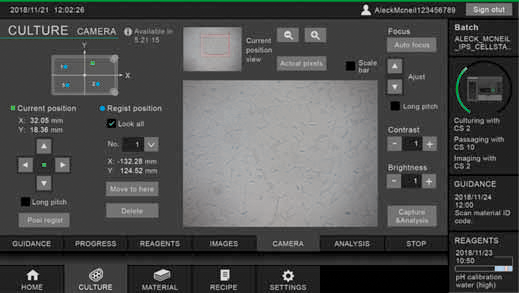
図4 細胞イメージングの設定と現状を示すモニタ画面
左上のXY座標の青色の印は設定した位置、緑色の印は現在観察中の位置を示し、フォーカスやコントラスト、明るさなどもモニタを見ながら変更できる。
また、細胞の状態を示す別の指標である、培地のpHやグルコース消費量、乳酸蓄積量はインラインセンサーで定期的に測定し、リアルタイムで確認できる。乳酸は細胞増殖速度の確認や継代時の播種細胞数を決める際のサロゲート指標としても使用する。そのほか、オフライン解析用の培地サンプリング機能を装備しており、培地成分の消費や代謝物の生成、サイトカインやエクソソームの産生などの測定に供することができる。
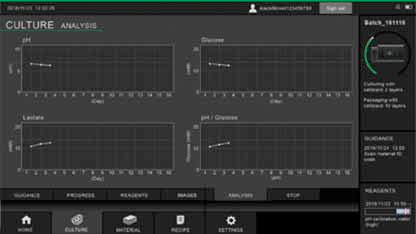
図5 インラインセンサーの測定値を経時的に示すモニタ画面
培地のpH、グルコースと乳酸濃度、ならびに任意の2つの指標の比を同時に表示できる。
全ての装置の動作はレシピとして登録することができるだけでなく、どのようなタイミングで遂行されるかを確認することもでき(図6)、レシピの誤設定を未然に防止することができる。
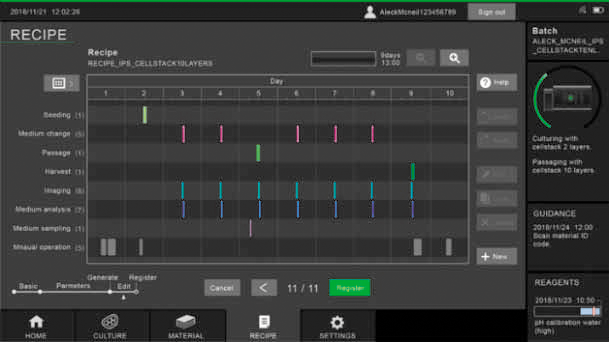
図6 装置の動作タイミングを示すレシピ画面
このほかにレシピを一覧表として管理する機能も有する。
CellQualia Intelligent Cell Processing Systemの導入で何が変わるか?
人手で製造する場合、作業者の稼働時間には制限があり、ケアレスミス等による作業の逸脱の可能性もあるが、本装置は播種から収穫までを全自動で行うので、製造の無人化ができる。また、完全閉鎖系なので培養中の微生物汚染のリスクが低く、装置を設置する環境のクリーン度はGrade Bでなくても良いと考える。また、イメージングに加えてインラインとオフラインの解析、すなわちProcess Analytic Technology (PAT)を搭載しているので、製造プロセスのデータが取得できるようになる。
細胞製造の問題点である不均質な原材料の品質や変動のある製造工程に対しては、『品質は最終段階でテストするだけでなくプロセスの段階ごとに確立する必要があり、これにより最終製品の一貫した品質を得ることができる』というQbD(Quality by Design)の考え方を採用するのが有効である。細胞のCQA(Critical Quality Attribute、品質規格値)やリスク評価に基づくDS (Design Space、規格許容幅)の設定や製造工程のPW(Process Window、工程幅) の設定を行い、製造プロセスのデータで品質を担保する。本装置ではPATによってリアルタイムで細胞の培養状態を観察・測定できるので、 DS や PWの範囲中にあると観察・測定されれば、製品バッチごとの品質確認、すなわちQbT(Quality by Testing)を行なわずとも製品を出荷することが出来る。
一方、CellQualia Intelligent Cell Processing Systemは単なる製造装置としての使い方だけでなく、細胞製品のCQAやプロセスのDS、PWを設定したり、品質マネジメントプラットフォームを構築したりするための基盤とすることも可能になる。その概念図を図7に示す。
年齢や健康状態といったドナーの情報や、採取から初代培養化、凍結までの手順と継代数、QC(quality control、品質管理)データなどは採取・分与機関から入手する。培地や継代試薬、培養容器などは、製品のロット番号とQA(quality assurance、品質保証)シートがベンダーから提供される。原材料の受け入れ時は各製造施設でのQCが行われ、製造プロセスデータは先述のように本装置で記録することができる。また、オフライン解析データや最終製品のQCデータや非臨床試験のデータなども製造プロセスと紐づけることができ、包装までの後工程や、保存、配送といったデータも収集して、MES(Manufacturing Execution System、製造実行システム)やLIMS(Laboratory Information Management System、ラボラトリー情報管理システム)といった上位の生産管理システムで統合する。さらに、臨床での投与量や有効性、副作用、新たな適用を目指した治験などのデータも加えることで、MSCを用いた医療をひとつのシステムとして統合することが可能になり、信頼性の高い医療として患者に提供することができる。当社ではFBRIの川真田先生と共同で、そのようなシステムの構築の検討も開始している。本装置の普及によってMSCの適用拡大と産業化が加速することを期待する。
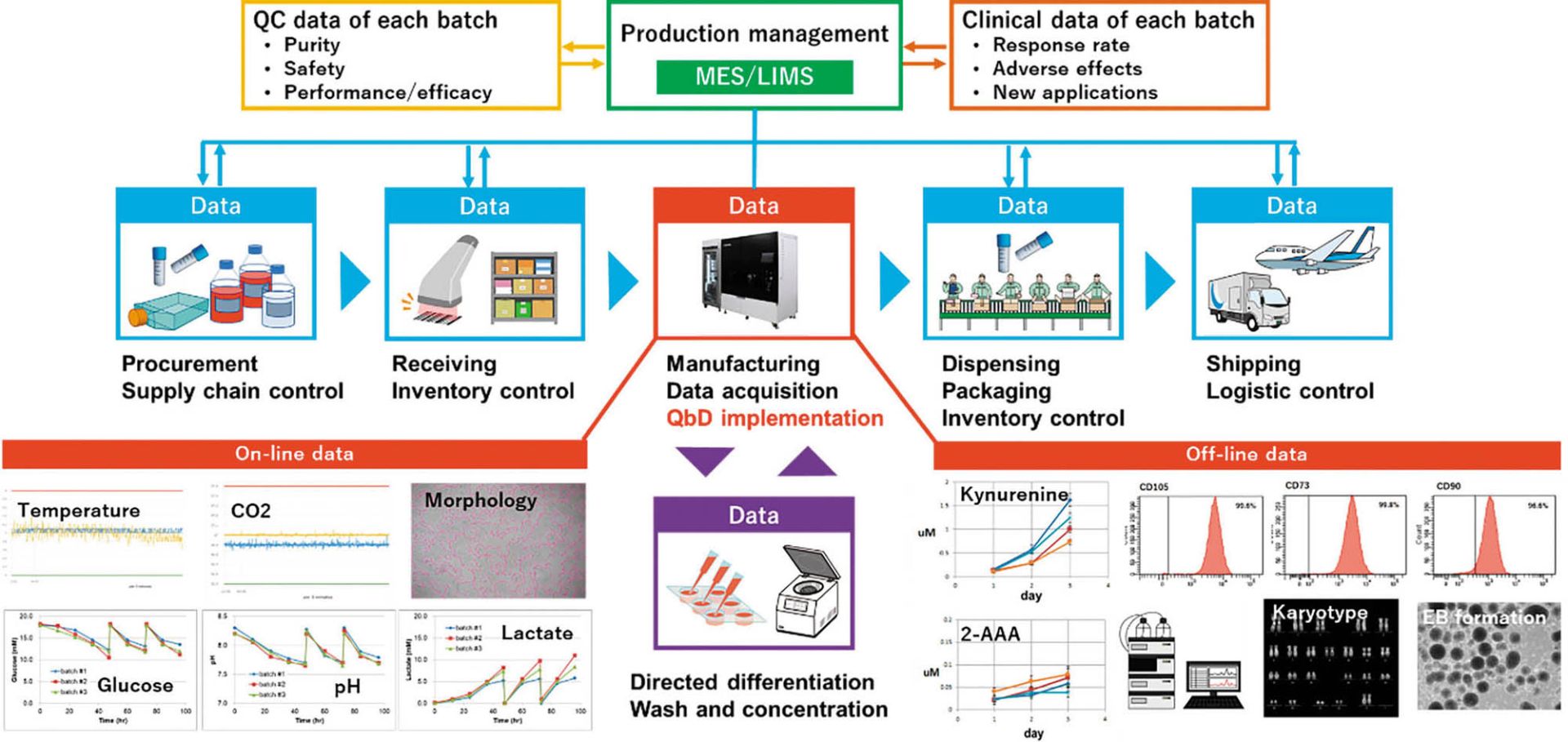
図7 CellQualia Intelligent Cell Processing Systemを核としたiPS細胞の生産・品質管理統合システム
参考文献
- Dominici M, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 2006;8(4):315-317.
- Wang L, et al. Efficacy and safety of mesenchymal stromal cells for the prophylaxis of chronic graft-versus-host disease after allogeneic hematopoietic stem cell transplantation: a meta-analysis of randomized controlled trials. Ann Hematol. 2018; 97(10): 1941-1950.
- Lalu MM, et al. Safety of cell therapy with mesenchymal stromal cells (SafeCell): a systematic review and meta-analysis of clinical trials. PLoS One. 2012; 7(10): e47559.
- Neri S and Borzì RM. Molecular Mechanisms
Contributing to Mesenchymal Stromal Cell Aging. Biomolecules. 2020; 10(2):340. - Stolzing A, et al. Age-related changes in human bone marrow-derived mesenchymal stem cells: consequences for cell therapies. Mech Ageing Dev. 2008;129(3):163-173.
- Andrzejewska A, et al. Multi-Parameter Analysis of Biobanked Human Bone Marrow Stromal Cells Shows Little Influence for Donor Age and Mild Comorbidities on Phenotypic and Functional Properties. Front Immunol. 2019; 10:2474.
- Rady D, et al. Mesenchymal Stem/Progenitor Cells: The Prospect of Human Clinical Translation. Stem Cells Int. 2020; 2020: 8837654.