技術レポートシリーズNo.003-0
Technical Report

技術レポートシリーズ No.003-0
2021/12/27 初版
② iPS細胞編
Contents
1. はじめに
2. iPS細胞由来製品の製造における課題
3. 自動細胞培養装置の必要性
4. 当社装置の特徴
5. CellQualia Intelligent Cell Processing System の導入で何が変わるか?
6. 参考文献
要旨:iPS細胞は、各個人の体細胞から作り出せる多能性幹細胞で、再生医療や創薬にイノベーションをもたらすと期待されている。一方、多能性細胞は様々な要因によって性質が変化し易いため、品質を維持しながら培養するのは難しく、産業スケールで培養するために様々な方法が検討されている。特に、iPS細胞のバンク化や、分化誘導して細胞製品を製造するには費用がかかるので、なるだけ製造プロセスの段階で品質の安定化あるいは変動の検出と制御を行なうのが望ましい。現在、人手による製造ばらつきの排除や、省力化、スケールアップなどのための各種培養装置やロボットが開発され、販売されているが、装置であればプロセスの質を測定・評価する手段を組み込むことができる。そこで当社は、プロセス解析技術を搭載し、iPS細胞の製造を、播種から収穫まで閉鎖系かつ全自動で製造できる装置としてCellQualia Intelligent Cell Processing Systemを新たに開発した。本装置を用いれば、バッチごとのプロセスデータの取得・蓄積・解析が可能になり、それらをもとにした品質管理が行える。本装置が最も威力を発揮するのが製造用のマスターセルバンクやワーキングセルバンクの作製で、刺激感受性の高い原料細胞の製造を管理・評価・記録できれば、それに続く分化誘導などの工程の精度の向上が見込まれる。また、ドナー、株、バッチが異なる細胞を用いてデータを蓄積することで、規格許容幅と工程幅を決めることができ、製品の品質をプロセスの質で規定するというQbDの考え方をiPS細胞の製造にも当てはめることが可能になる。iPS細胞株やそのバッチを変えると最終製品の製造効率に影響が出ると言われるが、原料の段階で見分けられれば、全体的には研究開発や製造の効率アップになるものと期待できる。
はじめに
iPS細胞(induced pluripotent stem cell:人工多能性幹細胞)は、体細胞をリプログラミングという方法で脱分化させて作製した細胞で(図1)、性状や形態がES細胞(embryonic stem cell:胚性幹細胞)により近づいたものを選別し、株化(細胞特性及び遺伝的背景が均一な細胞集団にすること)されて利用される。
ヒト多能性幹細胞(ES細胞とiPS細胞)はそれ自体をそのまま細胞医療や創薬研究などに使用するというよりは、身体の様々な細胞に分化誘導してから利用される。特に、個人から作製できるというiPS細胞の利点は、拒絶反応のない(自家細胞)、あるいはその可能性が極めて低い(組織適合性の高い他家細胞)細胞を原料にした細胞医薬品の製造や、疾患理解や個別化医療研究のためのモデル細胞の作製に適している。その一方で、分化多能性があると言う事は、培地やその添加物、接着基材、培地交換の頻度(栄養素の枯渇や老廃物の蓄積)や継代のタイミング(細胞の過密化)などでも性状(=品質)が容易に変動する可能性があり、一部が分化を開始することで不均一な細胞集団になりやすく、それらに起因する品質上の課題が指摘されている。また、ES細胞もiPS細胞も株間差の問題があり、現在の技術では100%同じ性状の細胞株を狙って再作製することは不可能に近いため、製品を安定して製造するためには、品質を維持したまま原材料となる株を拡大培養して凍結保存したバンク化細胞を用意する必要がある。
例えばiPS細胞を用いた細胞医薬品の製造の場合、ヒトの主要組織適合性抗原系であるHLA(ヒト白血球抗原) が特別な組み合わせのドナー、すなわちHLA-A、HLA-B、HLA-DRをいずれもホモ接合体で持ち、その組み合わせの出現頻度が高い場合、多くの患者に使用できる1)。あるいは、遺伝子編集技術を用いてHLAクラスI分子(全ての有核細胞や血小板に発現;HLA-A、B、C)のサブユニットであるβ2ミクログロブリンを機能喪失させたiPS細胞を利用するような試みもある2)。HLAホモのドナーの細胞をリプログラミングしたり、既存のiPS細胞の遺伝子を改変したりした後は、性状が安定化するまで継代したり、クローン化したりして株化し、凍結ストック(=バンク)を作製する。通常は単一のドナーから複数の株を作製し、また、複数のドナーから同様に複数の株を作製し、いわゆるシードバンクとする。その後、目的に合った性状のiPS細胞株を選択し、マスターセルバンク(原料のストック)、ワーキングセルバンク(製造の原料)をそれぞれ十分量作製し、製品製造の安定化を図る。これらのバンクをベンダーから購入したり、CMO/CDMOに作製を依頼したりする場合は、バンク細胞自体が製品であるとも言える。
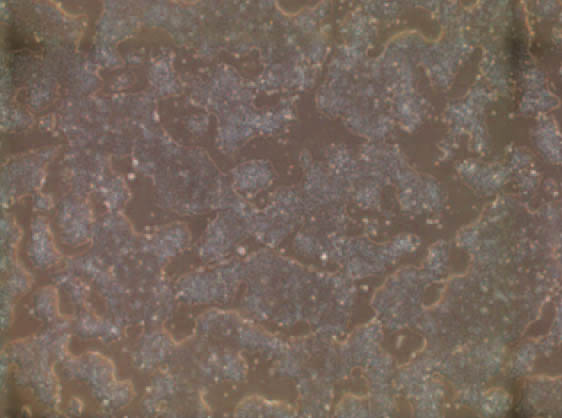
図1 ヒトiPS細胞(位相差像)
iPS細胞由来製品の製造における課題
前述のように多能性幹細胞であるiPS細胞は様々な要因によって性状が変化しやすい。そのため、マスターセルバンクやワーキングセルバンクの作製には細心の注意が必要である。そのため、現在は熟練者が経験をもとに培養中の細胞の形態を目視で判定し、継代のタイミングや播種密度、場合によっては培養の中断・破棄などを決めている。しかし、先にも述べたように、栄養素の枯渇や老廃物の蓄積、細胞の過密化などでも性状が容易に変動する可能性があり、見た目だけで品質を判断するのは危険である。厳密には、分化多能性を維持していることの確認や、核型が正常であることの確認を定期的に実施することが望ましいが、現実問題としては異常が発見された時には既に手遅れである。また、微細ではあるが重大な細胞の変化を逃さず検出することは非常に困難である。
製品の質を一定にする最も単純な方法は、製造のバッチサイズを極力大きくし、その一部を用いてそのバッチの品質を確認することである。ただ、この方式は、かなり大きなスケールで製造しない限り経済的に見合わないと思われ、バッチが変わった際に全く同じ品質の細胞が得られるという保証はない。
自動培養装置の必要性
iPS細胞は増殖が速く、必ずしも作業者の就労時間内に培地交換や継代、収穫のベストなタイミングが来るとは限らない。また、『培地交換を毎日行なう』と決めても、何かの理由で『前日は朝に交換、翌日は夕方に交換』や『前日は夕方に交換、翌日は朝に交換』のようなばらつきが生じれば、細胞の置かれた環境は大きく振れてしまう。CO₂インキュベーターから取り出して行なう細胞の観察も、高頻度や長時間行えば、培地の温度やpHの変動を引き起こす。また、人手では操作の質やタイミングなどの画一化や誤操作排除が難しく、原料から製品に至る培養手順を事細かに記録して後から確認するのは非常に困難なので、自動培養装置が必要となってくる。
既に、人手による製造ばらつきの排除や、省力化、スケールアップなどのための各種培養装置やロボットが開発・市販されている。ロボットはフレキシビリティが高く、熟練者の作業をほぼ完全に模倣できる点が良く、装置はフレキシビリティには乏しいが各動作は単純化され、同じ動作を並行で行ったり異なる動作を組み合わせたりできる。また、装置の場合には、プロセスの解析・記録機能をその一部として組み込むことができる。培養中の細胞の画像や装置内の環境情報を取得して記録する装置は多いが、細胞の状態をさらに詳細にモニタするためには、細胞の代謝物解析なども行わなければならず、インライン分析用のセンサーや、オフライン分析用のサンプリング機能が必要になる。そこで当社では、再生医療の産業化における品質管理の問題に取り組んでおられる公益財団法人神戸医療産業都市推進機構(FBRI)の川真田伸先生との協業により、PAT(Process Analytical Technology、プロセス解析技術)を搭載したCellQualia Intelligent Cell Processing Systemを開発した。

図2 CellQualia Intelligent Cell Processing Systemの外観
本体は、冷蔵ユニット(左側)とインキュベーターユニット(右側)から構成される。
当社装置の特徴
図2に装置の外観を示す。冷蔵ユニットでは、バックに詰めた培地や試薬、培養中に採取した培地サンプルや収穫した細胞などをカセットに収納して冷蔵保存する。インキュベーターユニットは多層フラスコを設置する培養ユニットを2つ内蔵し、培地交換だけでなく、ユニット間の継代も自動で行うことができる。各バッグとフラスコは図3で示すように流路(チューブ)で繋がれ、完全な閉鎖系を形成する。多層フラスコは市販のものに対応し、最大で36層のものが装着できる。
チューブ類とバッグはテンプレートと呼ぶ支持板に固定した形式で提供し、装着エラーを減らすように工夫している。また、テンプレートはディスポーザブルとすることで細胞のクロスコンタミネーションが防止され、無菌接続端子の採用によって微生物汚染が防止される。
人手での培養の場合、定点観測的に同じ場所の細胞を観察することは難しいが、当社の装置では培養中に容器の下部にCMOSカメラが設置され、あらかじめ設定した場所(最大5か所)を定期的に撮影するだけでなく、図3で示すようなモニタ画面上から操作してカメラを別の場所に移動させ、他の部位の細胞の状態を任意のタイミングで確認することもできる。また、装置の付属ソフトウエアでコロニーの端部を認識し、それをもとに細胞の専有面積を算出することで、いわゆるconfluencyを数値化することもできる。
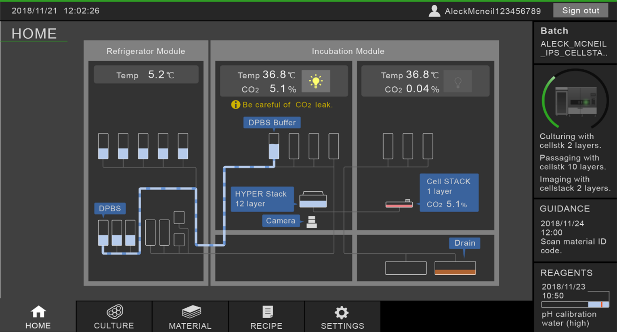
図3 培養プロセスのモニタ画面
流路系の構成と各バッグの液量、送液の状態、培養環境温度やCO₂濃度、カメラの位置などが表示される。
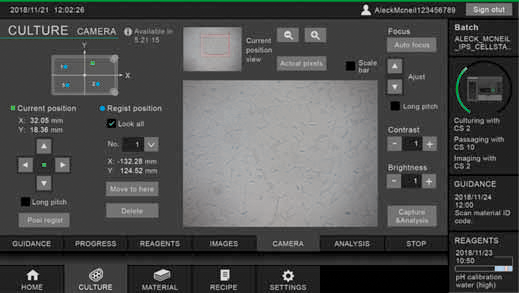
図4 細胞イメージングの設定と現状を示すモニタ画面
左上のXY座標の青色の印は設定した位置、緑色の印は現在観察中の位置を示し、フォーカスやコントラスト、明るさなどもモニタを見ながら変更できる。
また、細胞の状態を示す別の指標である、培地のpHやグルコース消費量、乳酸蓄積量はインラインセンサーで定期的に測定し、リアルタイムで確認できる。乳酸は細胞増殖速度の確認や継代時の播種細胞数を決める際のサロゲート指標としても使用する。そのほか、オフライン解析用の培地サンプリング機能を装備しており、培地成分の消費や代謝物の生成、サイトカインやエクソソームの産生などの測定に供することができる。
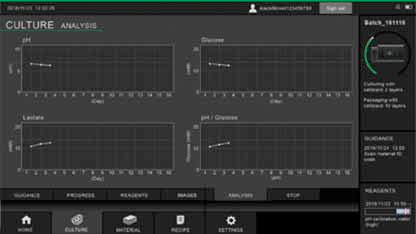
図5 インラインセンサーの測定値を経時的に示すモニタ画面
培地のpH、グルコースと乳酸濃度、ならびに任意の2つの指標の比を同時に表示できる。
全ての装置の動作はレシピとして登録することができるだけでなく、どのようなタイミングで遂行されるかを確認することもでき(図6)、レシピの誤設定を未然に防止することができる。
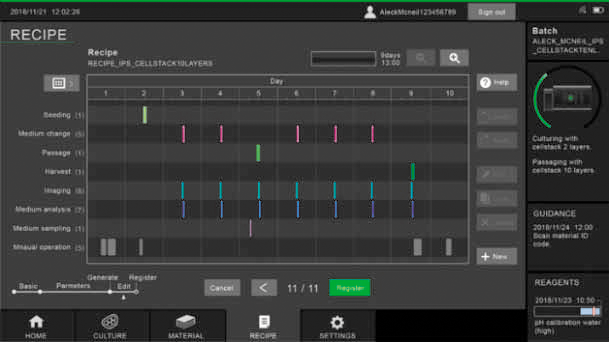
図6 装置の動作タイミングを示すレシピ画面
このほかにレシピを一覧表として管理する機能も有する。
CellQualia Intelligent Cell Processing Systemの導入で何が変わるか?
人手で製造する場合、作業者の稼働時間には制限があり、ケアレスミス等による作業の逸脱の可能性もあるが、本装置は播種から収穫までを全自動で行うので、製造の無人化ができる。また、完全閉鎖系なので培養中の微生物汚染のリスクが低く、装置を設置する環境のクリーン度はGrade Bでなくても良いと考える。また、イメージングに加えてインラインとオフラインの解析、すなわちProcess Analytic Technology (PAT)を搭載しているので、製造プロセスのデータが取得できるようになる。
iPS細胞の培養の場合、製造プロセスのデータのなかでも、オフラインでの代謝物解析が非常に重要である。FBRIの山本らは、未分化状態と分化が始まった状態の iPS 細胞/ES 細胞の培養液を経時的に分析し、その結果細胞が未分化な状態で維持されているときには、培養液中にキヌレニンというトリプトファン代謝物が分泌されており、未分化細胞が分化を始めるときには キヌレニンが代謝されて最終産物である2-アミノアジピン酸が分泌されるようになることを報告した3)。細胞の代謝の変化は遺伝子発現の変化よりも先に起こり、つまりこの2つの因子を指標にすることで、細胞の分化状態を早期に判断することが可能になる。当社装置はオフライン解析用のサンプリング機能を装備しており、現時点では最も感度の良い指標によってiPS細胞が未分化状態で維持できていることが確認できる。
細胞製造の問題点である不均質な原材料の品質や変動のある製造工程に対しては、『品質は最終段階でテストするだけでなくプロセスの段階ごとに確立する必要があり、これにより最終製品の一貫した品質を得ることができる』というQbD(Quality by Design)の考え方を採用するのが有効である。細胞のCQA(Critical Quality Attribute、品質規格値)やリスク評価に基づくDS (Design Space、規格許容幅)の設定や製造工程のPW(Process Window、工程幅) の設定を行い、製造プロセスのデータで品質を担保する。本装置ではPATによってリアルタイムで細胞の培養状態を観察・測定できるので、 DS や PWの範囲中にあると観察・測定されれば、製品バッチごとの品質確認、すなわちQbT(Quality by Testing)を行なわずとも製品を出荷することが出来る。
一方、CellQualia Intelligent Cell Processing Systemは単なる製造装置としての使い方だけでなく、細胞製品のCQAやプロセスのDS、PWを設定したり、品質マネジメントプラットフォームを構築したりするための基盤とすることも可能になる。その概念図を図7に示す。
年齢や罹患歴といったドナーの情報や、採取からリプログラミング、凍結までの手順と継代数、QC(quality control、品質管理)データなどは樹立担当者あるいは分譲機関などから入手する。培地や継代試薬、培養容器などは、製品のロット番号とQA(quality assurance、品質保証)シートがベンダーから提供される。原材料の受け入れ時は各製造施設でのQCが行われ、製造プロセスデータは先述のように本装置で記録することができる。また、オフライン解析データや最終製品のQCデータや非臨床試験のデータなども製造プロセスと紐づけることができ、包装までの後工程や、保存、配送といったデータも収集して、MES(Manufacturing Execution System、製造実行システム)やLIMS(Laboratory Information Management System、ラボラトリー情報管理システム)といった上位の生産管理システムで統合する。さらに、後工程である分化誘導や、その製品の品質データ、さらには臨床での投与量や有効性、副作用、新たな適用を目指した治験などのデータも加えることで、iPS細胞を用いた医療をひとつのシステムとして統合することが可能になり、信頼性の高い医療として患者に提供することができる。当社ではFBRIの川真田先生と共同で、そのようなシステムの構築の検討も開始している。本装置の普及によってiPS細胞の利用拡大と産業化が加速することを期待する。
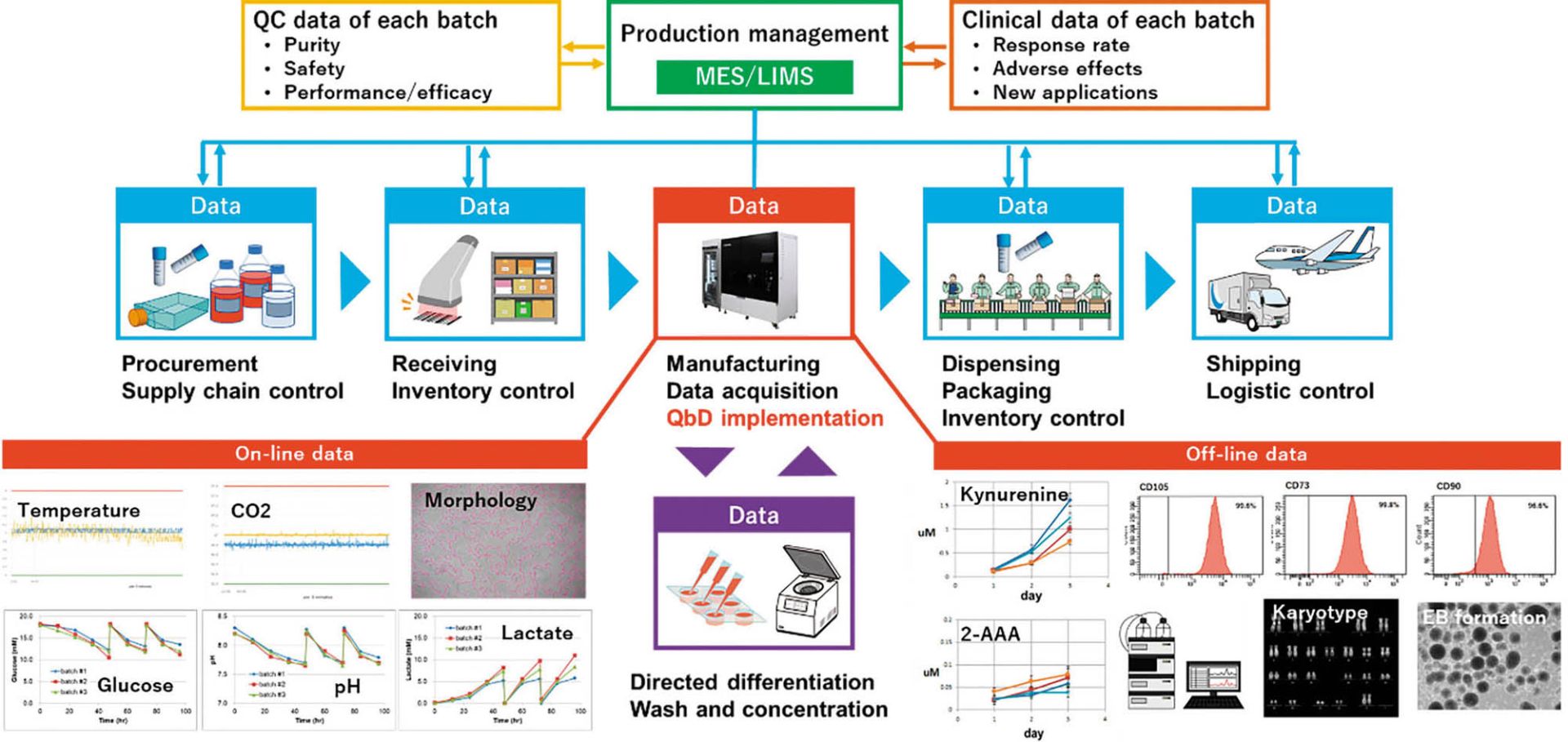
図7 CellQualia Intelligent Cell Processing Systemを核としたiPS細胞の生産・品質管理統合システム
参考文献
- Sullivan S, et al., Haplobanking induced pluripotent stem cells for clinical use. Stem Cell Res. 2020;49:102035.
- Wang B, et al., Generation of hypoimmunogenic T cells from genetically engineered allogeneic human induced pluripotent stem cells. Nat Biomed Eng.
2021;5(5):429-440 - Yamamoto T, et al. Kynurenine signaling through the aryl hydrocarbon receptor maintains the undifferentiated state of human embryonic stem cells. Sci Signal. 2019;12(587):eaaw3306.